| Alfa-amylaasi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
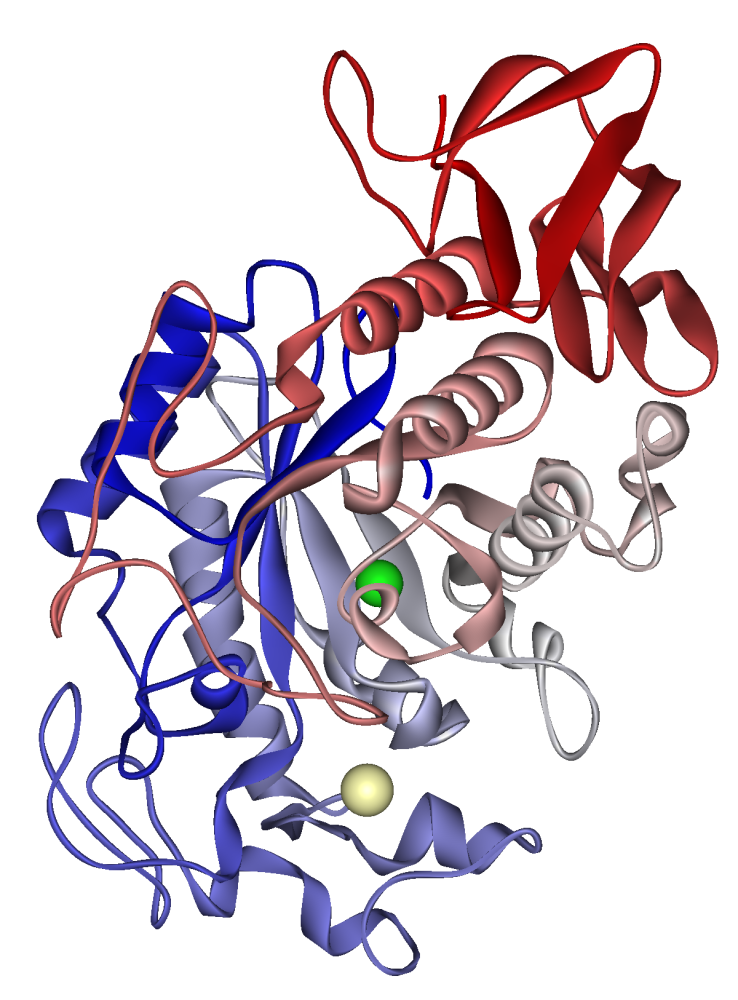
Ihmisen syljen amylaasi: kalsiumioni näkyy vaaleassa khakissa, kloridi-ioni vihreässä. ATE 1SMD
|
|||||||||
| Tunnisteet | |||||||||
| EY-nro | 3.2.1.0 | ||||||||
| CAS-nro | 9000-90-2 | ||||||||
| Tietokannat | |||||||||
| IntEnz | IntEnz-näkymä | ||||||||
| BRENDA | BRENDA-merkintä | ||||||||
| EXPASy | NiceZyme-näkymä | ||||||||
| KEGG | KEGG-merkintä | ||||||||
| MetaCyc | metabolinen reitti | ||||||||
| PRIAM | profiili | ||||||||
| ATE: n rakenteet | RCSB ATE PDBe ATE | ||||||||
|
|||||||||
| GH13-katalyyttinen domeeni | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Syklodekstriiniglukanotransferaasi (ec2.4.1.19) (cgtase)
|
|||||||||
| Tunnisteet | |||||||||
| Symboli | Alfa-amylaasi | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam-klaani | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM-superperhe | 117 | ||||||||
| OPM-proteiini | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Alfa-amylaasi-C-terminaalinen beeta-arkkidomeeni | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Ohran alfa-amylaasi-isotsyymi 1 (amy1) -aktiivisen mutantin d180a kiteinen rakenne kompleksissa maltoheptaoosin kanssa
|
|||||||||
| Tunnisteet | |||||||||
| Symboli | Alfa-amyyli_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alfa-amylaasi, C-terminaalinen all-beeta-domeeni | |||||||||
|---|---|---|---|---|---|---|---|---|---|
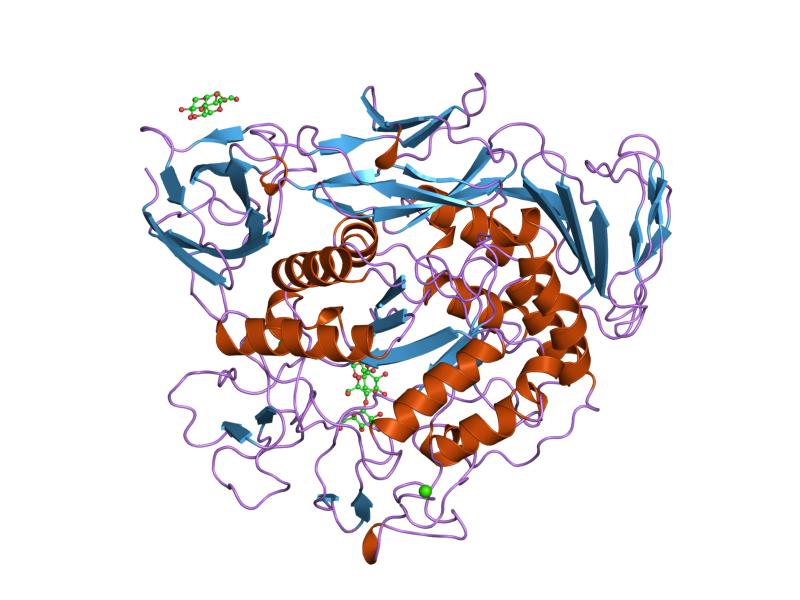
esivakioidun syklodekstriiniglykosyylitransferaasin mutantin maltotrioosikompleksi
|
|||||||||
| Tunnisteet | |||||||||
| Symboli | Alfa-amylaasi_C | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam-klaani | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amylaasi, (a-amylaasi) on entsyymi EC 3.2.1.1, joka hydrolysoi suurten, alfa-sitoutuneiden polysakkaridien, kuten tärkkelyksen ja glykogeenin, alfa-sidokset, jolloin saadaan niiden lyhyemmät ketjut, dekstriinit ja maltoosi. Se on tärkein amylaasin muoto, jota esiintyy ihmisillä ja muilla nisäkkäillä. Sitä esiintyy myös tärkkelystä sisältävissä siemenissä ruokareservinä, ja sitä erittävät monet sienet. Se on glykosidihydrolaasiperheen 13 jäsen.
Ihmisen biologiassa
Vaikka amylaasia esiintyy monissa kudoksissa, se on näkyvin haiman mehussa ja syljessä, joista jokaisella on oma ihmisen a-amylaasin isoformi. Ne käyttäytyvät eri tavalla isoelektrisessä fokusoinnissa, ja ne voidaan myös erottaa testeissä käyttämällä spesifisiä monoklonaalisia vasta-aineita. Ihmisillä kaikki amylaasi-isoformit linkittyvät kromosomiin 1p21 (katso AMY1A).
Syljen amylaasi (ptyaliini)
Amylaasia löytyy syljestä ja se hajottaa tärkkelyksen maltoosiksi ja dekstriiniksi. Tätä amylaasimuotoa kutsutaan myös ptyaliiniksi /ˈtaɪ.lɪn/, jonka nimitti ruotsalainen kemisti Jöns Jacob Berzelius. Nimi on peräisin kreikkalaisesta sanasta πτυω (syljen), koska aine on saatu syljestä. Se hajottaa suuret, liukenemattomat tärkkelysmolekyylit liukoisiksi tärkkelyksiksi (amylodekstriini, erytrodekstriini ja akrodekstriini), jotka tuottavat peräkkäin pienempiä tärkkelyksiä ja lopulta maltoosia. Ptyaliini vaikuttaa lineaarisiin a (1,4) glykosidisidoksiin, mutta yhdisteen hydrolyysi vaatii entsyymin, joka vaikuttaa haarautuneisiin tuotteisiin. Mahahappo inaktivoi syljen amylaasin mahassa. Mahalaukun mehussa, jonka pH oli säädetty arvoon 3,3, ptyaliini inaktivoitui täysin 20 minuutissa 37 ° C: ssa. Sitä vastoin 50% amylaasiaktiivisuudesta säilyi 150 minuutin altistuksen jälkeen mahamehulle pH-arvossa 4,3. Sekä tärkkelys, ptyaliinin substraatti että tuote (lyhyet glukoosiketjut) pystyvät suojaamaan sitä osittain mahahapon inaktivaatiolta. Puskuriin, jonka pH oli 3,0, lisätty ptyaliini inaktivoitui täydellisesti 120 minuutissa; tärkkelyksen lisääminen 0,1%: n tasolla johti kuitenkin 10%: n aktiivisuuteen, ja samanlainen tärkkelyksen lisääminen 1,0%: n tasoon johti noin 40%: n aktiivisuuteen jäljellä 120 minuutin kohdalla.
Optimaaliset olosuhteet ptyaliinille
- Optimaalinen pH – 7,0
- Ihmisen ruumiinlämpö
- Tiettyjen anionien ja aktivaattorien läsnäolo:
- Kloridi ja bromidi – tehokkaimmat
- Jodidi – vähemmän tehokas
- Sulfaatti ja fosfaatti – vähiten tehokas
Geneettinen vaihtelu ihmisen syljen amylaasissa
Syljen amylaasigeeni on läpikäynyt evoluution aikana, ja DNA-hybridisaatiotutkimukset osoittavat, että monilla yksilöillä on useita tandem-toistoja geenissä. Geenikopioiden lukumäärä korreloi syljen amylaasipitoisuuksien kanssa, mitattuna proteiiniblot-määrityksillä käyttäen vasta-aineita ihmisen amylaasille. Geenikopioluku liittyy ilmeiseen evoluutioaltistukseen korkean tärkkelyksen ruokavalioon. Esimerkiksi japanilaisella yksilöllä oli 14 kopiota amylaasigeenistä (yksi alleeli, jossa oli 10 kopiota, ja toinen alleeli, jossa oli neljä kopiota). Japanilainen ruokavalio on perinteisesti sisältänyt suuria määriä riisitärkkelystä. Sitä vastoin Biakan yksilöllä oli kuusi kopiota (kolme kappaletta kullakin alleelilla). Biaka ovat sademetsien metsästäjä-keräilijöitä, jotka ovat perinteisesti nauttineet vähän tärkkelystä sisältävää ruokavaliota. Perry ja hänen kollegansa spekuloivat syljen amylaasigeenin lisääntyneen kopiomäärän, joka voi olla parantanut selviytymistä samaan aikaan siirtymällä tärkkelyspitoiseen ruokavalioon ihmisen evoluution aikana.
Haiman amylaasi
Haiman a-amylaasi katkaisee satunnaisesti amyloosin a (1-4) glykosidisidokset dekstriinin, maltoosin tai maltotrioosin tuottamiseksi. Se hyväksyy kaksinkertaisen siirtomekanismin anomeerisen konfiguraation säilyttämisellä. Ihmisillä syljen amylaasi kehittyi sen kopiosta.
Patologiassa
Amylaasitesti on helpompi suorittaa kuin lipaasi, joten se on ensisijainen testi haimatulehduksen havaitsemiseksi ja seuraamiseksi. Lääketieteelliset laboratoriot mittaavat yleensä joko haiman amylaasia tai kokonaisamylaasia. Jos mitataan vain haiman amylaasia, lisääntymistä ei havaita sikotaudin tai muun sylkirauhasen trauman yhteydessä.
Pienen läsnäolomäärän takia ajoitus on kuitenkin kriittinen verinäytteitä otettaessa tätä mittausta varten. Veri on otettava pian haimatulehduksen jälkeen, muuten se erittyy nopeasti munuaisten kautta.
Syljen a-amylaasia on käytetty stressin biomarkkerina ja sympaattisen hermoston (SNS) aktiivisuuden sijaismarkkerina, joka ei vaadi verenottoa.
Tulkinta
Ihmisillä plasmassa on kohonnut:
- Syljen trauma (mukaan lukien anestesia-intubaatio)
- Sikotauti – sylkirauhasten tulehduksen takia
- Haimatulehdus – amylaasia tuottavien solujen vaurioitumisen vuoksi
- Munuaisten vajaatoiminta – vähentyneen erittymisen vuoksi
Amylaasilukemat, jotka ovat yli 10 kertaa normaalin ylärajan (ULN), viittaavat haimatulehdukseen. Viisi – 10 kertaa ULN voi osoittaa ileus- tai pohjukaissuolitautia tai munuaisten vajaatoimintaa, ja matalampia kohotuksia esiintyy yleisesti sylkirauhasten sairaudessa.
Geenit
- sylki – AMY1A, AMY1B, AMY1C
- haima – AMY2A, AMY2B
Viljassa
α-amylaasiaktiivisuus viljassa mitataan esimerkiksi Hagberg – Perten-putoamisnumerolla, versolla itävahinkojen arvioimiseksi tai Phadebas-menetelmällä. Esiintyy vehnässä.
Teolliseen käyttöön
α-amylaasia käytetään etanolin tuotannossa jyvissä olevien tärkkelysten hajottamiseksi fermentoitaviksi sokereiksi.
Ensimmäinen vaihe korkeafruktoosisen maissisiirapin tuotannossa on maissitärkkelyksen käsittely a-amylaasilla, jolloin saadaan lyhyempiä sokerioligosakkaridiketjuja.
Α-amylaasi nimeltään ”Termamyl”, peräisin Bacillus licheniformis, käytetään myös joissakin pesuaineissa, erityisesti astianpesu- ja tärkkelystä poistavissa pesuaineissa.
Katso amylaasi saadaksesi lisätietoja amylaasiperheen käytöstä yleensä.
Mahdollisuus lääketieteelliseen käyttöön
a-amylaasilla on ollut tehoa hajotettaessa mikrobien bakteeribiofilmejä hydrolysoimalla a (1-4) glykosidisidokset solunulkoisen polymeeriaineen (EPS) rakenteellisissa matriisi-eksopolysakkarideissa.
Puskurin esto
Tris-molekyylin on ilmoitettu estävän useita bakteerien a-amylaaseja, joten niitä ei tulisi käyttää tris-puskurissa.
Päättäväisyys
A-amylaasiaktiivisuuden määrittämiseksi on käytettävissä useita menetelmiä, ja eri teollisuudenalat pyrkivät luottamaan erilaisiin menetelmiin. Tärkkelysjoditesti, joka on joditestin kehitys, perustuu värimuutokseen, koska a-amylaasi hajottaa tärkkelystä ja sitä käytetään yleisesti monissa sovelluksissa. Samanlainen mutta teollisesti tuotettu testi on Phadebas-amylaasitesti, jota käytetään laadullisena ja määrällisenä testinä monilla teollisuudenaloilla, kuten pesuaineet, erilaiset jauho-, vilja- ja mallasruoat sekä rikostekninen biologia.
Verkkotunnuksen arkkitehtuuri
a-amylaasit sisältävät useita erillisiä proteiinidomeeneja. Katalyyttisellä domeenilla on rakenne, joka koostuu kahdeksan säikeisestä alfa / beeta-tynnyristä, joka sisältää aktiivisen kohdan, jonka keskeyttää ~ 70 aminohapon kalsiumia sitova domeeni, joka työntyy beeta-juosteen 3 ja alfa-heliksin 3 väliin, ja karboksyyliterminaalinen kreikkalainen avain beetatynnyrialue. Useat alfa-amylaasit sisältävät beeta-arkkidomeenin, yleensä C-päässä. Tämä verkkotunnus on järjestetty viisisäikeiseksi antiparalleeliseksi beeta-arkiksi. Useat alfa-amylaasit sisältävät all-beeta-domeenin, yleensä C-päässä.
.
















