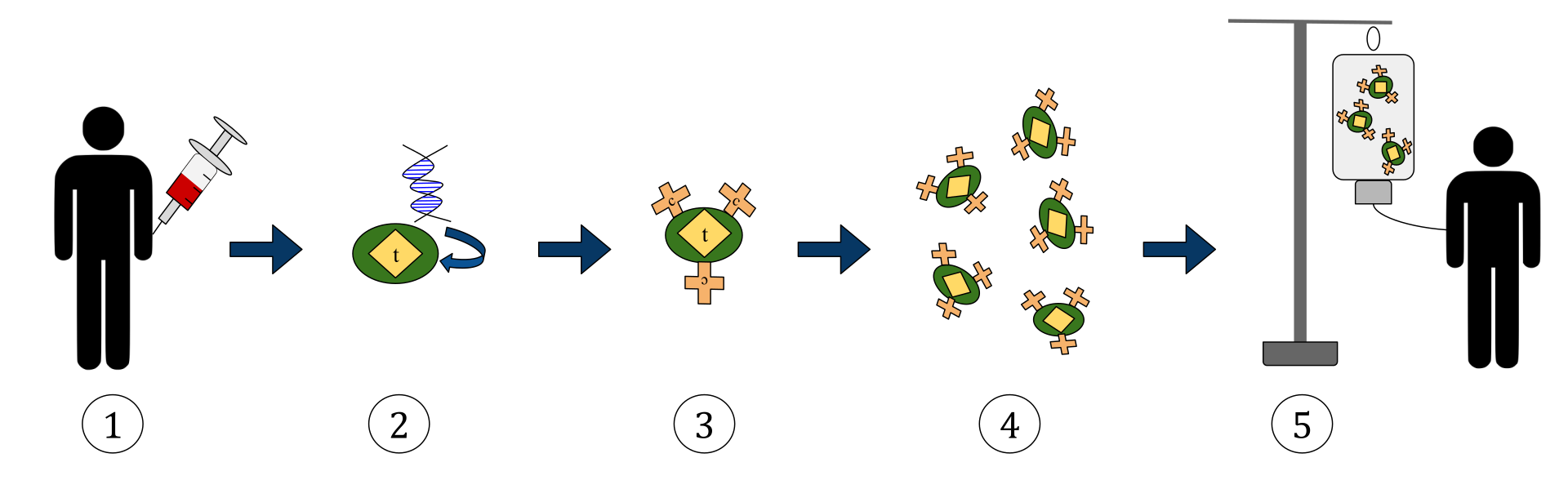
Yllä oleva kaavio kuvaa kimeerisen antigeenireseptorin T-soluterapian (CAR) prosessia. Tämä on immunoterapiamenetelmä, joka on kasvava käytäntö syövän hoidossa. Lopputuloksen tulisi olla sellaisten varustettujen T-solujen tuotanto, jotka tunnistavat ja vastustavat tartunnan saaneita syöpäsoluja kehossa.
1. T-solut (joita edustaa esineillä, jotka on merkitty nimellä ’t’) poistetaan potilaan verestä.
2. Sitten laboratoriossa, jossa spesifisiä antigeenireseptoreita koodaava geeni sisällytetään T-soluihin.
3. Näin tuotetaan CAR-reseptorit (merkitty c: llä) solujen pinnalle.
4. Vastamodifioidut T-solut kerätään sitten edelleen ja kasvatetaan laboratoriossa.
5. Tietyn ajan kuluttua valmistetut T-solut infusoidaan takaisin potilaaseen.
Kimeerisen antigeenireseptorin T-solut (tunnetaan myös CAR T-solut) ovat T-soluja, jotka on muunnettu geneettisesti tuottamaan keinotekoinen T-solureseptori immunoterapiassa käytettäväksi.
Kimeeriset antigeenireseptorit (AUTOT, tunnetaan myös kimeeriset immunoreseptorit, kimeeriset T-solureseptorittai keinotekoiset T-solureseptorit) ovat reseptoriproteiineja, jotka on muokattu antamaan T-soluille uusi kyky kohdistaa tietty proteiini. Reseptorit ovat kimeerisiä, koska ne yhdistävät sekä antigeeniä sitovat että T-solua aktivoivat toiminnot yhdeksi reseptoriksi.
CAR-T-soluterapia käyttää T-soluja, jotka on kehitetty CAR: illa syöpähoitoon. CAR-T-immunoterapian lähtökohtana on muuttaa T-soluja tunnistamaan syöpäsolut kohdentamaan ja tuhoamaan ne tehokkaammin. Tutkijat keräävät T-soluja ihmisiltä, muuttavat niitä geneettisesti ja infusoivat sitten syntyneet CAR-T-solut potilaisiin hyökätä niiden kasvaimia vastaan. CAR-T-solut voivat olla joko peräisin potilaan oman veren (autologinen) T-soluista tai toisen terveellisen luovuttajan T-soluista (allogeeniset). Kun ne on eristetty ihmisestä, nämä T-solut muunnetaan geneettisesti ilmentämään tiettyä CAR: ta, joka ohjelmoi ne kohdentamaan kasvainten pinnalla olevan antigeenin. Turvallisuuden vuoksi CAR-T-solut suunnitellaan spesifisiksi antigeenille, joka ilmentyy kasvaimessa, jota ei ilmenty terveillä soluilla.
Kun CAR-T-solut on infusoitu potilaaseen, ne toimivat ”elävinä lääkkeinä” syöpäsoluja vastaan. Kun CAR-T-solut joutuvat kosketuksiin kohdennetun antigeenin kanssa solussa, ne sitoutuvat siihen ja aktivoituvat, sitten lisääntyvät ja muuttuvat sytotoksisiksi. CAR-T-solut tuhoavat solut useilla mekanismeilla, mukaan lukien laaja stimuloitu solujen lisääntyminen, mikä lisää niiden myrkyllisyyttä muille eläville soluille (sytotoksisuus) ja aiheuttamalla lisääntynyttä eritystä tekijöille, jotka voivat vaikuttaa muihin soluihin, kuten sytokiinit, interleukiinit ja kasvutekijät.
CAR-T-solujen tuotanto

Ensimmäinen vaihe CAR-T-solujen tuotannossa on T-solujen eristäminen ihmisen verestä. CAR-T-solut voidaan valmistaa joko potilaan omasta verestä, joka tunnetaan autologisena hoitona, tai terveellisen luovuttajan verestä, joka tunnetaan allogeenisena hoitona. Valmistusprosessi on sama molemmissa tapauksissa; vain alkuperäisen verenluovuttajan valinta on erilainen.
Ensinnäkin leukosyytit eristetään käyttämällä verisoluerotinta prosessissa, joka tunnetaan nimellä valkosolujen afereesi. Sitten perifeerisen veren mononukleaariset solut (PBMC) erotetaan ja kerätään. Valkosolujen afereesituotteet siirretään sitten solujen käsittelykeskukseen. Solunkäsittelykeskuksessa spesifisiä T-soluja stimuloidaan siten, että ne lisääntyvät aktiivisesti ja laajenevat suuriksi määriksi. Laajentumisen edistämiseksi T-soluja käsitellään tyypillisesti sytokiini-interleukiini 2: lla (IL-2) ja anti-CD3-vasta-aineilla.
Laajentuneet T-solut puhdistetaan ja transdusoidaan sitten geenillä, joka koodaa muokattua CAR: ta retrovirusvektorin kautta, tyypillisesti joko integroivan gammaretroviruksen (RV) tai lentiviruksen (LV) vektorin kautta. Nämä vektorit ovat erittäin turvallisia nykyaikana johtuen U3-alueen osittaisesta deleetiosta. Uusi geeninmuokkaustyökalu CRISPR / Cas9 on äskettäin käytetty retrovirusvektoreiden sijasta CAR-geenin integroimiseksi spesifisiin paikkoihin genomissa.
Potilas käy lymfodepletion kemoterapiassa ennen muokattujen CAR-T-solujen tuomista. Potilaan kiertävien leukosyyttien määrän ehtyminen säätelee tuotettujen sytokiinien määrää ja vähentää kilpailua resursseista, mikä auttaa muokattujen CAR-T-solujen laajenemista.
Kliiniset sovellukset
Maaliskuuhun 2019 mennessä maailmassa oli noin 364 kliinistä tutkimusta, joihin osallistui CAR-T-soluja. Suurin osa näistä tutkimuksista kohdistuu verisyöpiin: CAR-T-hoidot muodostavat yli puolet kaikista hematologisten pahanlaatuisten kasvainten tutkimuksista. CD19 on edelleen suosituin antigeenikohde, jota seuraa BCMA (yleisesti ilmaistu multippelissa myeloomassa). Vuonna 2016 tutkimuksissa alettiin tutkia muiden antigeenien, kuten CD20: n, elinkelpoisuutta. Kiinteiden kasvainten kokeita hallitsee vähemmän CAR-T, ja noin puolet soluterapiapohjaisista kokeista, joihin osallistui muita alustoja, kuten NK-soluja.
Syöpä
T-solut on geneettisesti muunnettu ilmentämään kimeerisiä antigeenireseptoreita, jotka on erityisesti suunnattu potilaan kasvainsolujen antigeeneihin, ja sitten ne infusoidaan potilaaseen, missä ne hyökkäävät ja tappavat syöpäsolut. CAR-proteiinia ilmentävien T-solujen adoptiivinen siirto on lupaava syöpälääke, koska CAR-modifioidut T-solut voidaan suunnitella kohdistamaan käytännöllisesti katsoen kaikki tuumoriin liittyvät antigeenit.
Varhainen CAR-T-solututkimus on keskittynyt verisyöpiin. Ensimmäisissä hyväksytyissä hoidoissa käytetään CAR-lääkkeitä, jotka kohdistuvat antigeeniin CD19, jota esiintyy B-soluista peräisin olevissa syöpissä, kuten akuutissa lymfoblastisessa leukemiassa (ALL) ja diffuusi suuressa B-solulymfoomassa (DLBCL). Lisäksi on pyritty kehittämään CAR-lääkkeitä, jotka kohdistuvat moniin muihin verisyövän antigeeneihin, mukaan lukien tulenkestävässä Hodgkinin lymfoomassa oleva CD30; CD33, CD123 ja FLT3 akuutissa myelooisessa leukemiassa (AML); ja BCMA multippelissa myeloomassa.
Kiinteät kasvaimet ovat osoittaneet vaikeamman kohteen. Hyvien antigeenien tunnistaminen on ollut haastavaa: tällaisten antigeenien on ilmentyttävä voimakkaasti suurimmalla osalla syöpäsoluista, mutta suurimmaksi osaksi niitä ei ole normaalissa kudoksessa. CAR-T-soluja ei myöskään liikennöi tehokkaasti kiinteiden tuumorimassojen keskelle, ja vihamielinen tuumorin mikroympäristö tukahduttaa T-solujen aktiivisuuden.
Autoimmuuni sairaus
Vaikka suurin osa CAR T-solututkimuksista keskittyy sellaisen CAR T-solun luomiseen, joka voi hävittää tietyn solupopulaation (esimerkiksi CAR-T-solut, jotka kohdistuvat lymfoomasoluihin), tällä tekniikalla on muita mahdollisia käyttötarkoituksia. T-solut voivat myös suojata itseantigeenejä autoimmuunireaktiolta. CAR: lla varustettu regulatiivinen T-solu voi olla potentiaalinen antaa suvaitsevaisuutta tietylle antigeenille, jota voitaisiin hyödyntää elinsiirroissa tai reumaattisissa sairauksissa, kuten lupus.
Satefy
CAR-T-solujen kulkeutumisesta elimistöön on vakavia sivuvaikutuksia, mukaan lukien sytokiinien vapautumisoireyhtymä ja neurologinen toksisuus. Koska kyseessä on suhteellisen uusi hoito, CAR-T-soluhoidon pitkäaikaisista vaikutuksista on vähän tietoa. CAR-T-soluilla hoidetuilla naispotilailla on edelleen huolta potilaan pitkäaikaisesta eloonjäämisestä sekä raskauden komplikaatioista. Anafylaksia on odotettu sivuvaikutus, koska CAR on valmistettu vieraalla monoklonaalisella vasta-aineella ja sen seurauksena provosoi immuunivasteen.
Kohteen tai kasvaimen ulkopuolella tapahtuva tunnistaminen tapahtuu, kun CAR-T-solu tunnistaa oikean antigeenin, mutta antigeeni ilmentyy terveessä, ei-patogeenisessä kudoksessa. Tämän seurauksena CAR-T-solut hyökkäävät ei-kasvainkudokseen, kuten terveisiin B-soluihin, jotka ilmentävät CD19: tä. Tämän haittavaikutuksen vakavuus voi vaihdella B-solujen aplasiasta, jota voidaan hoitaa tukevilla infuusioilla, äärimmäiseen toksisuuteen, joka johtaa kuolemaan.
On myös epätodennäköistä mahdollisuutta, että muokatut CAR-T-solut muuttuvat itse syöpäsoluiksi insertiomutageneesin kautta, johtuen virusvektorista, joka insertoi CAR-geenin isännän T-solun genomissa olevaan tuumorisuppressoriin tai onkogeeniin. Joillakin retrovirusvektoreilla (RV) on pienempi riski kuin lentivirusvektoreilla (LV). Molemmat voivat kuitenkin olla onkogeenisiä. CAR-insertiokohtien genomisekvensointianalyysi T-soluihin on perustettu CAR T-solujen toiminnan ja pysyvyyden ymmärtämiseksi paremmin in vivo.
Sytokiinien vapautumisoireyhtymä
Yleisin asia CAR-T-soluilla tapahtuvan hoidon jälkeen on sytokiinien vapautumisoireyhtymä (CRS), tila, jossa immuunijärjestelmä aktivoituu ja vapauttaa lisääntyneen määrän tulehduksellisia sytokiineja. Tämän oireyhtymän kliininen ilmentymä muistuttaa sepsistä, jolla on korkea kuume, uupumus, lihaskipu, pahoinvointi, kapillaarivuodot, takykardia ja muut sydämen toimintahäiriöt, maksan vajaatoiminta ja munuaisten vajaatoiminta. CRS esiintyy melkein kaikilla CAR-T-soluhoidolla hoidetuilla potilailla; itse asiassa CRS: n läsnäolo on diagnostinen markkeri, joka osoittaa, että CAR-T-solut toimivat tarkoitetulla tavalla tappamaan syöpäsolut. Huomaa kuitenkin, että korkeampi CRS-vaikeusaste ei korreloi lisääntyneen vasteen hoitoon, vaan pikemminkin korkeamman taudin taakan kanssa.
Immuuniefektorisoluihin liittyvä neurotoksisuus
Neurologinen myrkyllisyys liittyy usein myös CAR-T-soluhoitoon. Taustalla olevaa mekanismia ymmärretään huonosti, ja se voi olla tai ei välttämättä liity TPJ: ään. Kliinisiin ilmenemismuotoihin kuuluvat delirium, johdonmukaisen puhumisen kyvyn osittainen menettäminen samalla kun kykyä tulkita kieltä (ekspressiivinen afasia), heikentynyt valppaus (hämärtyminen) ja kohtaukset. Joissakin kliinisissä tutkimuksissa on esiintynyt neurotoksisuuden aiheuttamia kuolemia. Tärkein neurotoksisuuden aiheuttama kuolinsyy on aivojen turvotus. Juno Therapeutics, Inc: n suorittamassa tutkimuksessa viisi tutkimukseen ilmoittautunutta potilasta kuoli aivoödeeman seurauksena. Kaksi potilasta hoidettiin pelkästään syklofosfamidilla ja loput kolme hoidettiin syklofosfamidin ja fludarabiinin yhdistelmällä. Toisessa Fred Hutchinsonin syöpätutkimuskeskuksen tukemassa kliinisessä tutkimuksessa todettiin yksi peruuttamattoman ja kuolemaan johtaneen neurologisen toksisuuden tapaus 122 päivää CAR-T-solujen antamisen jälkeen.
.
















